مصطفى دعمس
المدير العام - الأستاذ مصطفى دعمس

عدد المساهمات : 1699
تاريخ التسجيل : 15/11/2010
العمر : 52
الموقع : منتدى المعلم مصطفى دعمس
 |  موضوع: الرابطة الأيونية موضوع: الرابطة الأيونية  الخميس أبريل 27, 2023 8:34 pm الخميس أبريل 27, 2023 8:34 pm | |
| الرابطة الأيونية: قوى جذب كهربائي تنشأ بين ذرتين إحداهما تميل لفقد الإلكترونات وتكوين أيون موجب الشحنة ، والأخرى تميل لفقد الإلكترونات وتكوين أيون سالب الشحنة. مثال: كلوريد الصوديوم يميل الصوديوم (فلز) للارتباط مع الكلور (لافلز) لتكوين كلوريد الصوديوم. التوزيع الإلكتروني للصوديوم هو: 1 , 8 , 2: 11Na تميل ذرة الصوديوم لفقد إلكترون ليصبح توزيعها الإلكتروني مشابهاً لتوزيع غاز النيون النبيل المستقر، فتصبح بذلك أيوناً موجباً +Na التوزيع الإلكتروني للكلور هو 7 , 8 , 2: 17Cl تميل ذرة الكلور لكسب إلكترون ليصبح توزيعها الإلكتروني مشابهاً لتوزيع غاز الآرغون النبيل المستقر، فتصبح بذلك أيوناً سالباً -Cl. وعندما يتجاذب أيون الصوديوم الموجب مع أيون الكلور السالب ينتج مركباً أيونياً ، وتنشأ بين الأيونين رابطة أيونية.  ويمكن تمثيل الرابطة برموز لويس بكتابة رموز العناصر، وتوضع عليها نقاط تمثل إلكترونات الغلاف الأخير.  انظر كيف تتكون رابطة أيونية بين الصوديوم والفلور: 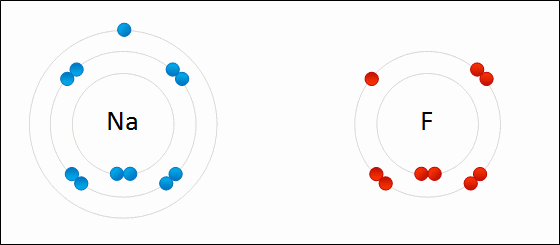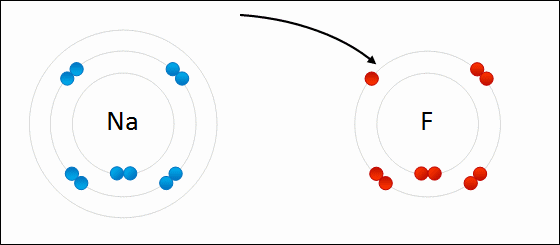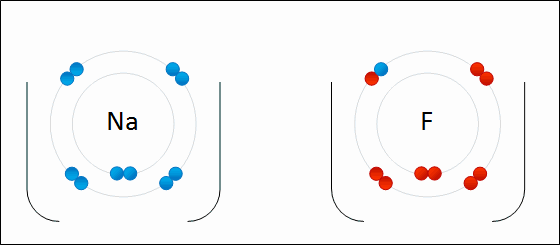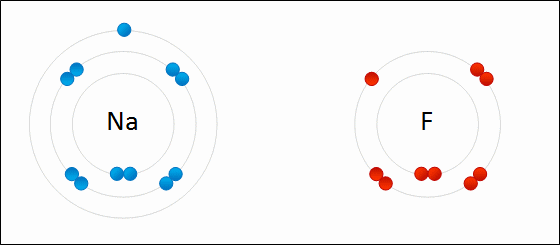 سؤال سؤال : وضح باستخدام رموز لويس كيف تنشأ الرابطة الأيونية بين: الألمنيوم والكلور. 
| |
|


