الدرس الثاني : الجدول الدوري وخصائص العناصر
لتسهيل دراسة العناصر، حاول العلماء تصنيفها، فرتّبوها في مصفوفة منظمة أطلقوا عليها اسم الجدول الدوري .
ومع تزايد أعداد العناصر المكتشفة، لاحظ العلماء وجود أوجه تشابه بين هذه العناصر من ناحية خصائصها ،سواء الفيزيائية أم الكيميائية ، وهذا ما تطلب تنظيمها وتصنيفها. فكانت هناك الكثير من المحاولات من أهمها :
- الجدول الدوري لمندليف : في عام 1869م نشر العالم الروسي دمتري مندليف نسخته الأولى من جدوله الدوري الذي رتّبت فيه العناصر وفقاً لتزايد أعدادها الكتلية.- هنري موزلي: في بداية القرن العشرين، طوّرالعالم الانجليزي جدول مندليف الدوري وتحسينه، رتّبت العناصر فيه وفقاً لتزايد أعدادها الذرية بدلاً من أعدادها الكتلية.الجدول الدوري الحديث : رتّبت العناصر فيه وفقاً لتزايد أعدادها الذرية، وقد تم ترتيب العناصر في الجدول الدوري الحديث استناداً إلى ثلاث أسس : 1- رُتّبت العناصر حسب ازدياد العدد الذري . 2- رُتّبت العناصر في صفوف أفقية سمّي كل صف منها دورة Period ؛ على أن تتغير خصائص العناصر في الصف الواحد تغيراً تدريجياً يمكن توقعه. 3- رُتّبت العناصر في أعمدة سمّي كل عمود منها مجموعة Group ، على أن تتشابه العناصر الموجودة في العمود الواحد في خصائصها الفيزيائية والكيميائية.عندما تتفحص الجدول الدوري ستجد أنّه ملون بألوان مختلفة تمثل العناصر إلى فلزات ولافلزات وشبه فلزات (لاحظ موقعها في الجدول الدوري وما علاقة رقم المجموعة في ذلك).  الدورات والمجموعات في الجدول الدوريالدورات في الجدول الدوريتنتظم العناصر في الجدول الدوري ضمن صفوف أفقية تسمى دورات، وعددها سبع دورات.تضم الدورة الأولى عنصران هما الهيدروجين H ، والهيليوم He .ونظراً إلى أنّ مستوى الطاقة الأول يتسع لإلكترونين فقط، فسيكون مستوى الطاقة الخارجي لذرة الهيليوم مكتملاً، وأي ذرة يكون مستواها الخارجي مكتملاً توصف بأنها مستقرة، أي إن الهيليوم يعدّ عنصراً مستقراً.
الدورات والمجموعات في الجدول الدوريالدورات في الجدول الدوريتنتظم العناصر في الجدول الدوري ضمن صفوف أفقية تسمى دورات، وعددها سبع دورات.تضم الدورة الأولى عنصران هما الهيدروجين H ، والهيليوم He .ونظراً إلى أنّ مستوى الطاقة الأول يتسع لإلكترونين فقط، فسيكون مستوى الطاقة الخارجي لذرة الهيليوم مكتملاً، وأي ذرة يكون مستواها الخارجي مكتملاً توصف بأنها مستقرة، أي إن الهيليوم يعدّ عنصراً مستقراً.والدورة الثانية تشمل ثمانية عناصر تبدأ من الليثيوم Li وتنتهي بالنيون Ne الذي يحتوي على 10 إلكترونات، فمستوى الطاقة الأول يتسع لإلكترونين ، و8 إلكترونات في مستوى طاقته الخارجي. فالتوزيع الإلكتروني لعناصر هذه الدورة ينتهي في مستوى الطاقة الثاني الذي يتسع لـِ 8 إلكترونات في حده الأقصى، فهذا يعني أنّ مستوى الطاقة الخارجي مكتمل وممتلئ بالإلكترونات، وعندئذٍ توصف الذرة بأنها مستقرة، أي إن النيون عنصر مستقر أيضاً.
والأمر نفسه في الدورة الثالثة ، حيث تبدأ هذه الدورة بعنصر الصوديومNa وتنتهي بعنصر الآرجون Ar.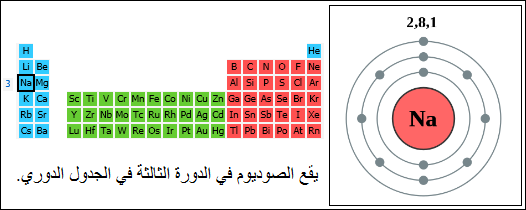
إنّ عدد المستويات الموجودة حول نواة العنصر هي التي تحدد رقم الدورة (الصف) التي يوجد فيها العنصر.
المجموعات في الجدول الدوريعندما تتفحص الجدول الدوري مرة أخرى ، ستجد أنّه يتكون من (18) عموداً، ويتكون كل عمود من مجموعة أو عائلة من العناصر ، وأنّ عناصر المجموعة الواحد تتشابه في خصائصها الفيزيائية والكيميائية.ويبين الشكل التالي مناطق الجدول الدوري، وتتضمن المنطقة الأولى التي تسمى مجموعة العناصر الممثّلة، المجموعتين الأولى والثانية، والمجموعات من 13 إلى 18. أما العناصر التي توجد في المجموعات من 3 إلى 12 فتسمى مجموعة العناصر الانتقالية 
| عناصر المجموعة الأولى ( القلويات ) | خصائصها |
ليثيوم Li
صوديوم Na
بوتاسيوم K
روبيديوم Rb | صلبة ونشطة في تفاعلاتها
تحتوي على إلكترون واحد في مستوى طاقتها الخارجي
تسمى مجموعة القلويات
لها خصائصها الفيزيائية |
| عناصر المجموعة الثانية (القلويات الترابية) | خصائصها |
بريليوم Be
مغنيسيوم Mg
كالسيوم Ca
باريوم Ba | صلبة
تحتوي على إلكترونين في مستوى طاقتها الخارجي
تسمى مجموعة القلويات الترابية
لها خصائصها الفيزيائية |
ويتضمن العمود الثالث من العناصر الممثّلة أو العمود 13 من الجدول الدوري عناصر المجموعة الثالثة أو الثالثة عشرة التي تبدأ بعنصر البورون ( (5Bوتحته عنصر الألمنيوم (13Al) ، وعناصر هذه المجموعة فلزات صلبة ، ما عدا البورون الذي هو شبه فلز أسود اللون وهش ، وتحتوي على ثلاثة إلكترونات في مستوى طاقتها الخارجي، وهكذا.
ويتضمن العمود الرابع من العناصر الممثّلة أو العمود 14 من الجدول الدوري عناصر المجموعة الرابعة أو الرابعة عشرة التي تبدأ بعنصر الكربون ( (4Cوتحته عنصر السليكون (14Si) ، وعناصر هذه المجموعة يمكن أن تكون فلزات أو لافلزات أو أشباه فلزات ، وتحتوي على أربعة إلكترونات في مستوى طاقتها الخارجي، وهكذا.
أما الأعمدة من الخامس إلى السابع من العناصر الممثّلة أو الأعمدة من الخامس عشر إلى السابع عشر من الجدول الدوري تتضمن عناصر المجموعات الخامسة أو الخامسة عشرة ، إلى المجموعة السابعة أو السابعة عشرة على التوالي ، وعناصر هذه المجموعات يمكن أن تكون لافلزات أو أشباه فلزات ، وتحتوي على خمسة إلكترونات وستة وسبعة على التوالي في مستوى طاقتها الخارجي، وهكذا.
نلاحظ مما سبق أنّ كل مجموعة من المجموعات المرتبة في أعمدة في الجدول الدوري تحتوي على عناصر لها العدد نفسه من الإلكترونات في مستوى طاقتها الخارجي، لذا فهي متشابهة في خصائصها الكيميائية. ونستنتج أنّ عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي لأي عنصر هي التي تحدد رقم المجموعة التي يقع فيها هذا العنصر.
الكترونات التكافؤ عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي لأيّ عنصر.أكمل الجدول (ص 71)العنصر | رمزه | عدده الذري | التوزيع الإلكتروني | عدد مستويات الطاقة | الدورة التي يقع فيها | عدد الكترونات التكافؤ | المجموعة التي يقع فيها |
| الليثيوم | | 3 | | | | | |
| الكربون | | 6 | | | | | |
| النيون | | 10 | | | | | |
| المغنيسيوم | | 12 | | | | | |
| الكلور | | 17 | | | | | |
| الآرجون | | 18 | | | | | |
تسمى الذرات التي تقع في المجموعة18 في الجدول الدوري بالغازات النبيلة أو الخاملة، وسميت بذلك لأنها هي فقط التي تمتلك مستويات طاقة خارجية مكتملة وممتلئة بالإلكترونات، فهي بذلك عناصر مستقرة ولا تميل للتفاعل، مثل عنصر الهيليوم 2He: 2 ، وعنصر النيون 10Ne: 2 , 8 ، وعنصر الآرجون 18Ar: 2 , 8 , 8 ، وعنصر الكربتون 36Kr: 2 , 8 , 18 , 8 .
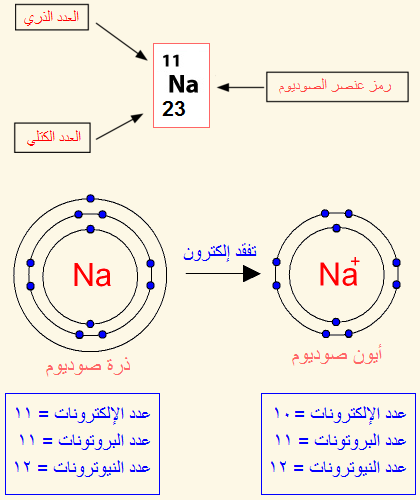
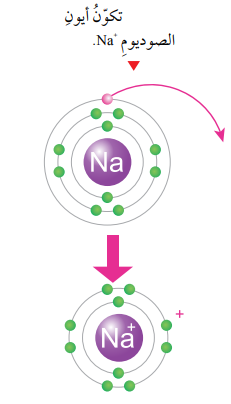
ان الوصول لحالة الاستقرار يعني الوصول إلى توزيع إلكتروني مشابه للتوزيع الإلكتروني للغازات النبيلة، ويحدث هذا الاستقرار للذرات ؛ عندما تفقد هذه الذرات الإلكترونات أو تكتسبها ، أو تُشارك فيها، فعندما تفقد أي ذرة إلكترونات من مستوى طاقتها الخارجي ،أو تكتسبها تكوّن ما يسمى الأيون Ion.ويمكن أن تكون الأيونات المتكونة موجبة بسبب فقدانها الإلكترونات أو سالبة بسبب اكتسابها للإلكترونات. تكوّن الأيون الموجب Cation Formationيتكوّن الأيون الموجب عندما تفقد الذرة إلكتروناً واحداً أو أكثر، وعندئذ ستحمل شحنة موجبة بعدد الإلكترونات التي فقدتها ، ويحدث هذا لذرات العناصر التي توجد في المجموعات 1، و2، و13 من الجدول الدوري.فمثلاً يتكون أيون الصوديوم +Na ، عندما تفقد ذرة الصوديوم (Na11) الإلكترون الموجود في مستوى طاقتها الخارجي ، ليصبح توزيعها الإلكترون مشابهاً لتوزيع ذرة النيون (Ne10) المستقرة الموضحة في الشكل.
ويتكون أيون المغنيسيوم +Mg2 ، عندما تفقد ذرة المغنيسيوم Mg12) الإلكترونين الموجودين في مستوى طاقتها الخارجي ، ليصبح توزيعها الإلكترون مشابهاً لتوزيع ذرة النيون (Ne10) أيضاً الموضحة في الشكل.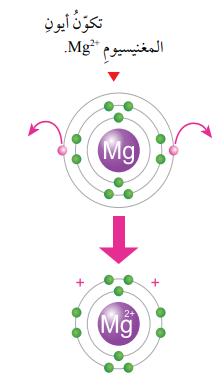
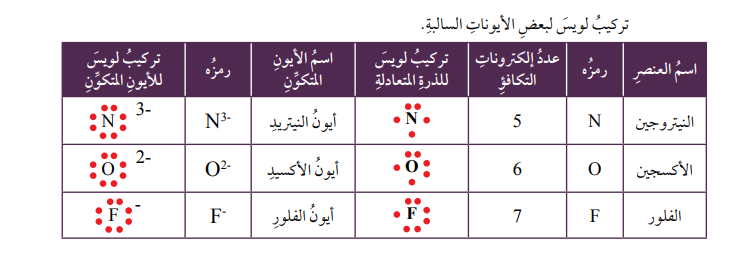
أتحقق: أوضح بالرسم كيف يتكون أيون الألمنيوم الموجب.تكوّن الأيون السالب Anion Formation يتكوّن الأيون السالب عندما تكتسب الذرة إلكتروناً واحداً أو أكثر، وعندئذ ستحمل شحنة سالبة بعدد الإلكترونات التي اكتسبتها ، ويحدث هذا لذرات العناصر التي توجد في المجموعات 15، و16، و17 من الجدول الدوري.فمثلاً يتكون أيون الكلوريد -Cl، عندما تكتسب ذرة الكلور (Cl17) إلكتروناً واحداً ليكتمل به مستواها الخارجي الذي يحتوي 7 إلكترونات تكافؤ ، ويصبح عددها 8، وبذلك يصبح توزيعها الإلكتروني مشابهاً لتوزيع ذرة الآرجون (Ar18) المستقرة الموضحة في الشكل. |

|
ويتكون أيضاً أيون الكبريتيد – S2، عندما تكتسب ذرة الكبريت (S16) إلكترونين ليكتمل به مستواها الخارجي الذي يحتوي 6 إلكترونات تكافؤ ، فيصبح عددها 8، وعليه يصبح توزيعها الإلكتروني مشابهاً لتوزيع ذرة الآرجون (Ar18) المستقرة الموضحة في الشكل. |

|
تركيب لويس النقطي للذرات والأيونات
توصّل العلماء إلى نموذج بسيط يوضح عدد إلكترونات التكافؤ للذرات أطلق عليه اسم تركيب لويس النقطي Lewis Dot Structure للإلكترونات ؛ وهو عبارة عن نموذج يكون فيه رمز ذرة العنصر محاطاً بنقاط تمثل عدد إلكترونات التكافؤ .
فمثلاً يمكن التعبير عن ذرة الصوديوم والأيون المتكون عنها باستخدام تركيب لويس النقطي على النحو الآتي: | | |
ويمكن التعبير عن ذرة المغنيسيوم والأيون المتكون عنها باستخدام تركيب لويس النقطي على النحو الآتي: | | |
ويمكن التعبير عن ذرة الكلور والأيون المتكون عنها باستخدام تركيب لويس النقطي على النحو الآتي: | | |
ويمكن التعبير عن ذرة الكبريت والأيون المتكون عنها باستخدام تركيب لويس النقطي على النحو الآتي: | ` | |
ويمكن التعبير عن ذرة عنصر عدد إلكترونات التكافؤ لها = 5 والأيون المتكون عنها باستخدام تركيب لويس على النحو الآتي: |  |
|

|



